Le parasympathique sacré : naissance de l’anatomie d’un mythe.
Vous avez probablement tous appris comme moi que le système nerveux neurovégétatif qui participe à la gestion de notre homéostasie est composé en deux systèmes antagonistes et complémentaires : la composante orthosympathique et la composante para sympathique.
Isabel Espinoza Medina a fait sa thèse publiée en 2017 sur le développement des systèmes nerveux parasympathique, entérique et sacré. Elle a exploré les différentes migrations et interactions neuronales et dépendances moléculaires lors de la neurogénèse du SNA. A la suite de ces travaux elle propose un réexamen du système nerveux sacré, qui régule les fonctions urinaire, digestive et reproductrice.
Ce dernier étant considéré comme parasympathique depuis plus d’un siècle, sans argument moléculaire.
Elle a publié plusieurs articles à ce sujet :
- Espinosa-Medina, E. Outin, C. A. Picard, Z. Chettouh, S. Dymecki, G. G. Consalez, E. Coppola, J. F. Brunet, Parasympathetic ganglia derive from Schwann cell precursors. Science 345, 87–90 (2014).
- Espinosa-Medina, O. Saha, F. Boismoreau, Z. Chettouh, F. Rossi, W. D. Richardson and J.-F. Brunet The sacral autonomic outflow is sympathetic Science 354 (6314), 893-897 (2016).
- Espinosa-Medina, O. Saha, F. Boismoreau and J.-F. Brunet The “sacral parasympathetic”: ontogeny and anatomy of a myth. Clin Auton Res (2018) 28:13–21
Depuis une équipe d’expert s’acharne a critiquer ses travaux (Jänig et al 2016, Jänig et al 2017 2 fois !! Jänig et al 2018) et les débats font du bruit dans Landerneau !!!
Le billet de blog suivant résume et expose essentiellement les travaux d’Espinoza et son point de vue qui répond aux différentes critiques de l’équipe de Jänig.
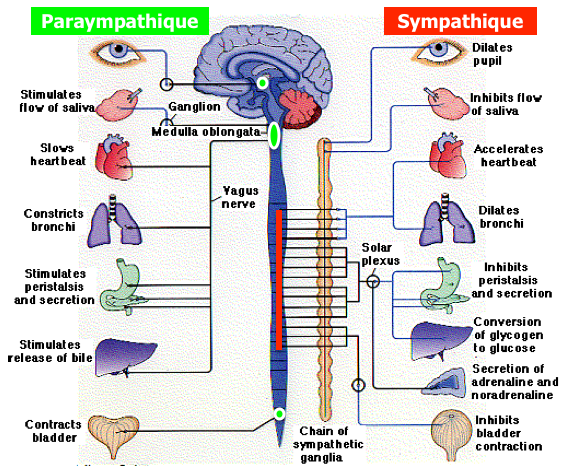
Quand on passe les détails des centres supra-segmentaires (hypothalamus et système limbique) et des afférences du SNA, et que l’on se penche uniquement sur les neurones effecteurs pré-ganglionaires du système nerveux central, nous avons appris que ceux-ci provenaient (figure ci-dessus) :
- De la corne inter-médio-latérale de la moelle de C8 à L2 pour le système orthosympathique (en rouge sur la figure) ;
- Des noyaux du tronc cérébral (II, VII, IX et X) et de la corne inter-médio-latérale de la moelle de S2 à S4 pour le système parasympathique (en vert sur la figure).
L’affectation de cet influx autonome sacré à la division parasympathique du système nerveux viscéral comme 2° sortie du parasympathique a été proposé par Langley en 1899 « de manière remarquablement superficielle, avec une brève justification suivie d’une réaffirmation dans 2 articles en 1905 et 1911 » et depuis cela n’a jamais été contredit (Espinoza 2018).
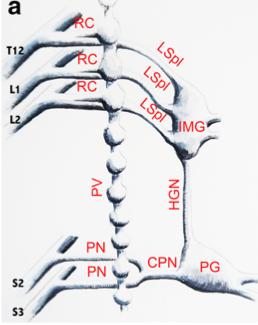
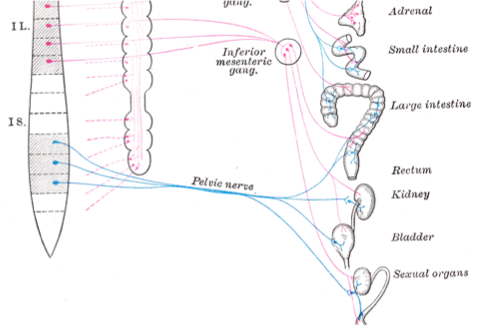
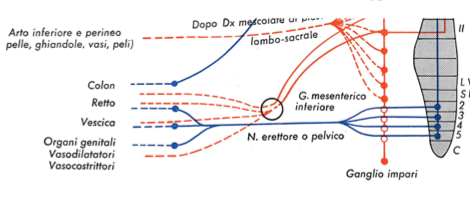
| A tel point que l’on a considéré le plexus hypogastique inférieur/ganglion pelvien (PG sur la photo) comme mixte, un cas unique à l’époque pour un ganglion du SNA.
Celui-ci est mixte car il reçoit des entrées thoraco-lombaires (par les nerfs hypogastriques) et sacrées (par les nerfs pelviens NP sur la photos ou nerfs splanchniques pelviens ). |
 |
Un des exemples flagrant de l’obscurantisme concernant la non remise en question des assertions de Langley est la réprésentation du ganglion pelvien (ou plexus hypogastique inférieur) : ce ganglion et/ou sa connection orthosympathique ont été omis des schémas anatomiques par les auteurs les plus connus (Gaskell, Testut, même le Gray’s anatomie) dans le domaine :
Ci-dessous on peut voir comment on a, soit considéré ce ganglion uniquement comme relais parasympathique, soit le ganglion n’est même pas représenté.
Figures en provenance de l’article d’Espinosa et al 2018 :
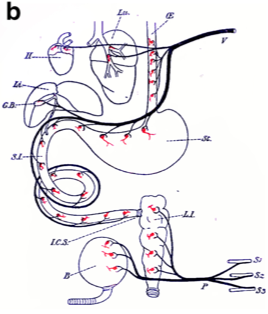
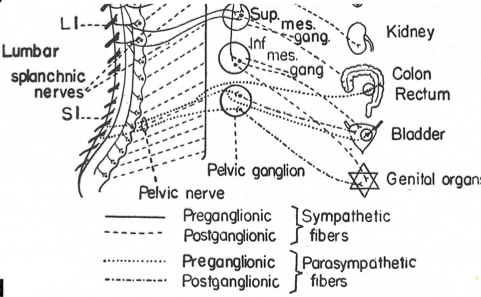
On peut remarquer sur le schéma de Gaskell (figue b) qu’il représente les neurones post-ganglionnaires de la même façon pour le nerf vague que pour les nerfs splanchniques pelviens, comme si il avait voulu collé l’idée d’un « nerf vague pelvien ».
Espinosa et al 2018, apporte des éléments et contre éléments de réflexions anatomiques, physiologiques, pharmacologiques et génétiques, en faveur ou non d’un parasympathique sacré d’origine médullaire.
D’un point de vue anatomique :
- Le trou de zone intermédiolatérale au niveau lombaire pose une question qui a servi de support au fait de dire que la moelle sacrée était du parasympathique. Cet argument n’est pas suffisant et peut très bien se comprendre d’un point de vue de l’évolution : avec la station debout et la nécessité de locomotion, un épuisement ontogénétique de neurones préganglionnaires lombaires et sacré a très bien pu se faire en faveur des motoneurones pour le membre inférieur (ces nerfs proviennent des mêmes précurseurs embryologiques).
- L’absence de rameau communicant blanc (par lequel passent les afférences et l’efference préganglionnaire orthosympathique) au niveau lombaire bas et sacré avec la chaine latérovertébrale.
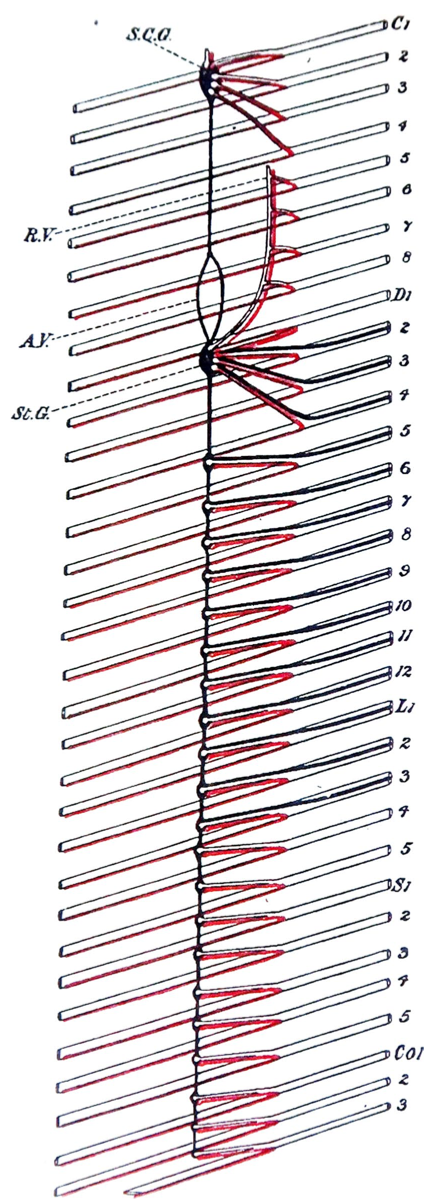
Il n’existe pas non plus ces rameaux communicants au niveau cervical (ou il y a des ganglions cervicaux) et le ganglion pelvien pourrait très bien être considéré par analogie à un ganglion cervical inférieur.
A contrario d’un point de vue anatomique :
- Au départ du tronc cérébral tous les points de sorties du système parasympathique sont postérolatérales, alors que dans la moelle efferences neurovégétatives thoracolombaires et sacrés sont ventrales(par la branche antérieures du nerf spinal);
- Sur le trajet autonome sacré vers l’intestin, les partenaires présynaptiques des neurones entériques se trouvent dans le système nerveux périphérique (dans les ganglions pelviens), tout comme sur la voie thoraco-lombaire (dans les ganglions mésentériques), tandis que sur la voie crânienne, ils se trouvent dans le système nerveux central (dans le noyau moteur dorsal du nerf vague):
- Un certain nombre de neurones ganglionnaires pelviens individuels reçoivent une double innervation lombo-sacrée tout comme le font les neurones ganglionnaires mésentériques inférieurs.
Il n’y a pas d’argument anatomique en faveur d’une justification d’un système parasympathique « cranio-sacré »
D’un point de vue pharmacologique :
Le système parasympathique a été décrit comme cholinergique car le neurotransmetteur effectif est l’acetylcholine qui se fixe sur des récepteurs muscariniques au niveau des organes cibles.
Le système sympathique a été décrit comme adrénergique car le neurotransmetteur effectif est la noradrénaline au niveau des organes cibles.
La sensibilité des «substances réceptives» aux agonistes et aux antagonistes a joué un rôle majeur dans la consolidation de la proposition de Langley comme quoi le système parasympathique cranio-sacré ne soit qu’un seul et même système : la pilocarpine (agoniste des récepteurs muscariniques) imite plusieurs réactions physiologiques à la stimulation des nerfs splachniques pelviens (comme la salivation ou le myosis), reflétant le fait que les ganglions pelviens contiennent de nombreux neurones cholinergiques.
Sauf que :
- Depuis 1934 (Dale et Feldberg) on sait que le système orthosympathique a aussi des récepteurs muscariniques qui réagissent à l’acetylcholine(notamment dans les glandes sudoripares, la pilocarpine fait transpirer).
- Tous les neurones préganglionaires du SNA sont sous dépendance de l’acétylcholine(récepteurs muscarinique ou nicotinique pour le sympathique et uniquement muscarinique pour le parasympathique)
Donc la présence de neurones cholinergiques dans les nerfs splanchniques pelviens n’est pas une preuve qu’ils sont de fonction parasympathique.
D’un point de vue physiologique :
A propos de la miction :
Un des arguments cité est par Langley et d’autres, est la fonction l’antagonisme lombo-sacré sur le muscle detrusor de la vessie et en particulier l’inhibition sympathique lombaire. En l’occurrence aucune expérimentation jusqu’à ce jour n’a prouvé son existence, ni même la présence de fibre sympathique dans le muscle détrusor (Espinosa et al 2018).
Au contraire il a été démontré que le bloc de conduction sur le système sympathiquelombaire chez l’homme n’a pas de conséquence fonctionnelle sur la miction (Folwer et al 2008).
A propos de l’érection (tiré de la thèse d’Espinosa 2017):
« De même, la croyance en un antagonisme parasympathique / sympathique dans le pelvis a conduit à négliger la preuve d’un rôle de la contribution sympathique lombaire dans l’érection (donc dans la dilatation des vaisseaux sanguins), généralement présentée comme étant médiée exclusivement par les nerfs parasympathiques sacrés. En 1979 déjà, Sjöstrand et Klinge affirmaient l’existence de fibres sympathiques hypogastriques participant à l’érection… » (et dans son article de 2018, Espinosa expose d’autres études expérimentales démontrant que l’érection était médiée à travers des voies orthosympathiques cholinergiques)
« …Il existe des preuves d’une synergie des voies lombaires et sacrales de la vasodilatation dans les organes reproducteurs externes(Jänig, 2006) qui plaide contre un antagonisme entre eux … et pourtant la plupart des revues maintiennent le dogme de l’antagonisme. »
D’un point de vue génétique et moléculaire :
Dans son premier travail Espinosa et al 2014 démontre que la « signature neurale des nerfs parasympathiques crâniensprovient des précurseurs des cellules de Schwann(SCPs) qui envahissent les nerfs préganglionaires jusqu’à leur destination, proche des organes cibles ».
Elle a fait la même chose pour les neurones sympathiques thoraco-lombaires en montrant que c’était une signature neurale particulière (différente du parasympathique crânien)
Dans son second article (Espinosa et al 2016) elle démontre que les neurones en provenance de la zone intermédiolatérale de la moelle sacréeont la même signature neurale que les neurones sympathiques thoraco-lombaireset que les ganglions pelviens ont une signature transcriptionnelle sympathiqueet non para-sympathique :

Le système nerveux sacré est en fait sympathique.
En Conclusion :
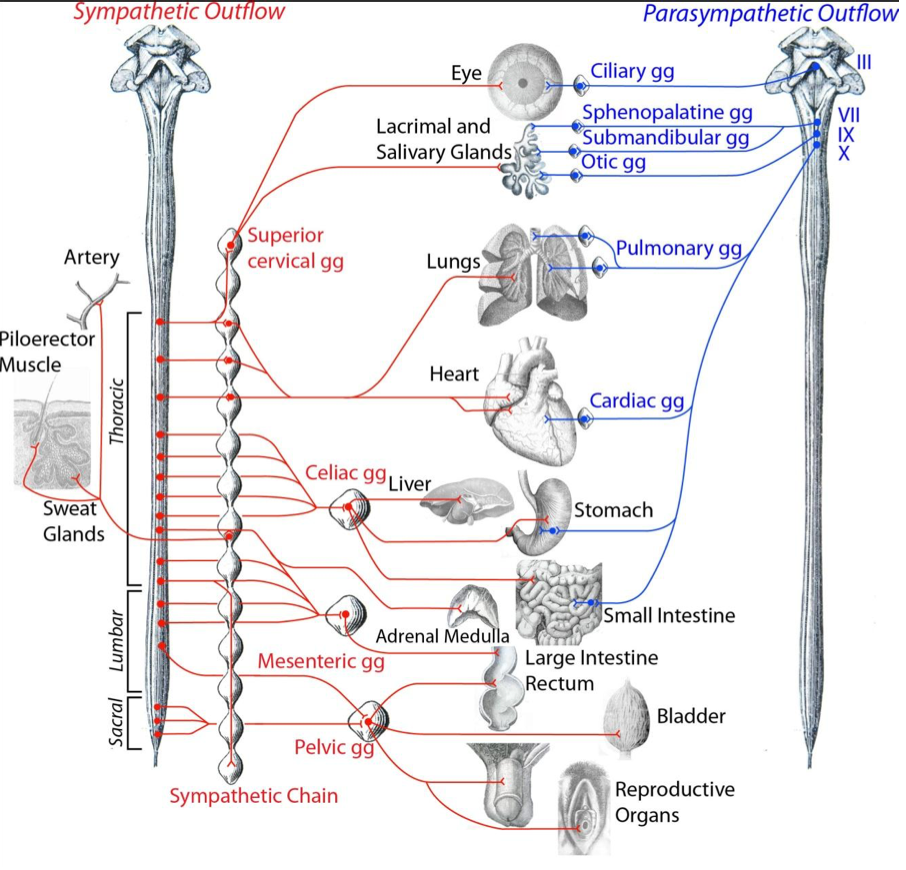
Tout d’abord Espinoza-Medina propose donc une nouvelle organisation du système nerveux autonome composé de trois divisions contrastées par leur origine embryonnaire aussi bien que par leur anatomie adulte:
une parasympathiqued’origine et de connectivité exclusivement crânienne,
une sympathique spinale, allant de l’étagecervical au sacré(Espinosa-Medina et al., 2016)
et une division entériqueque son origine aussi bien que sa connectivité placent à l’interface des systèmes sympathique et parasympathique.
Au niveau pelvien, la science est en train de déchiffrer la complexité du fonctionnement homéostatique (différents types de cellules et fonctions), et il est claire qu’il n’est pas comparable aux autres viscères. Il serait donc illusoire de l’expliquer par fonctions l’antagonisme anatomique parasympathique/ orthosympathique.
PS : Une remarque sur tous ces travaux d’Espinoza-Medina :
Ces études ont été faites sur les rats , et c’est vrai qu’en recherche on commence toujours par l’animal (du plus petit vers le plus gros : rat, lapin, chat…cheval..). Les résultats de ces travaux sont donc à confirmer chez l’homme.
Ceci étant :
- Aucune recherche sur l’humain ni sur l’animal n’a à ce jour montré que le système nerveux autonome sacré était parasympathique;
- D’autre part une équipe française (Alsaid et al 2009) a fait un traçage immunohistochimique chez des fœtus humain male et a montré dans les nerfs splanchniques pelviens la présence de fibres cholinergiques et des adrénergique (le système orthosympathique est le seul à présenter ces deux types de fibres, le parasympathique n’a que des fibres cholinergique)
Alsaid B et al. 3D reconstruction of the inferior hypogastric plexus. J. Anat. (2009) 214, pp645–654
Dale HH, Feldberg W (1934) The chemical transmission of secretory impulses to the sweat glands of the cat. J Physiol 82:121–128.
Espinosa-Medina . On the development of the parasympathetic, enteric and sacral nervous systems. Thèse de Doctorat de biologie du développement. UPMC (2017).
Espinosa-Medina, E. Outin, C. A. Picard, Z. Chettouh, S. Dymecki, G. G. Consalez, E. Coppola, J. F. Brunet, Parasympathetic ganglia derive from Schwann cell precursors. Science 345, 87–90 (2014).
Espinosa-Medina, O. Saha, F. Boismoreau, Z. Chettouh, F. Rossi, W. D. Richardson and J.-F. Brunet The sacral autonomic outflow is sympathetic Science 354 (6314), 893-897 (2016).
Espinosa-Medina, O. Saha, F. Boismoreau and J.-F. Brunet The “sacral parasympathetic”: ontogeny and anatomy of a myth. Clin Auton Res (2018) 28:13–21
Gaskell WH (1920) The involuntary nervous system. Longmans, Green, New York
Jänig, The Integrative Action of the Autonomic Nervous System: Neurobiology of Homeostatis (Cambridge Univ. Press, Cambridge, UK, 2006).
Jänig W, Keast J, McLachlan E, Neuhuber W, Southard-Smith M (2016) E-Letter. In: Science
Janig W, Keast JR, McLachlan EM, Neuhuber WL, Southard- Smith M (2017) Renaming all spinal autonomic outflows as sym- pathetic is a mistake. Auton Neurosci 206:60–62
Janig W, McLachlan EM, Neuhuber WL (2018) The sacral auto- nomic outflow: against premature oversimplification. Clin Auton Res. https://doi.org/10.1007/s10286-017-0491-x
Janig W, Neuhuber W (2017) Reclassification of the sacral auto- nomic outflow to pelvic organs as the caudal outpost of the sympa- thetic system is misleading. J Am Osteopath Assoc 117:416–417
Langley JN (1899) Presidential address, physiological section. Report of the 69th meetings of the British Association for the Advancement of Science. John Murray, London, pp 881–892
Langley JN (1905) On the reaction of cells and of nerve-endings to certain poisons, chiefly as regards the reaction of striated muscle to nicotine and to curari. J Physiol 33:374–413
Langley JN (1911) The effect of various poisons upon the response to nervous stimuli chiefly in relation to the bladder. J Physiol 43:125–181. doi:10.1111/(ISSN)1469-7793
Latarjet A, Testut L (1948) Traité d’anatomie humaine. G. Doin & Cie, Paris
Sjöstrand, N. O. and Klinge, E. « Principal mechanisms controlling penile retraction and protrusion in rabbits ». Acta Physiologica Scandinavica. Volume 106, no.2 (June 1979): 199–214.

Je suis ostéopathe, d’abord clinicien et puis mon parcours m’a amener a participer à des projets de recherche et d’enseignement.
A la sortie de mes études, remplies de dogmes thérapeutiques de la SEO (sainte église ostéopathique), je ne savais pas faire grand chose, et je ne comprenais pas pourquoi mes traitements fonctionnaient ou pas. Cette approche ne convenait pas à ma démarche d’analyse critique. J’ai donc choisi de suivre un parcours plus universitaire et je me suis plongé dans l’Evidence Base Medecine en participant à des publications d’articles scientifiques et en travaillant sur des projets de recherches (toujours en cours). Et je me suis rendu compte que comme dans le monde de l’ostéopathie, la médecine était aussi pleines de fausses croyances, et que leur modèle biomédical de la prise en charge de la douleur ne convenait pas vraiment.
C’est dans les neurosciences que j’ai pu enfin trouvé la voie du milieu entre tradition et sciences biomédicales.
Je me suis donc intéressé aux mécanismes neurophysiologiques de la douleur et grâce au courant Australien très en pointe (Robert Elvey, Lorimer Moseley, David Butler, Peter O’sullivan…) j’ai trouvé un intérêt particulier à prendre en charge la douleur sur le modèle bio-psycho-social, en portant un intérêt particulier aux douleurs du nerf (neuropathique). Dans le suivi des travaux d’Elvey, c’est en 2007 que j’ai eu la chance de rencontrer et suivre un élève de Bob Elvey, Philip Moulaert que j’assiste maintenant.
Durant mes différentes formations à l’étranger je me suis rendu compte qu’il y a avait peu de français. Je me suis aussi rendu compte que la langue était un barrage à l’arrivée des découvertes révolutionnaires de ces 15 dernières années, qui sont en train de changer la thérapie manuelle. Je voulais partager cela avec les thérapeutes manuels qui sont intéressés par ces informations mais qui n’ont pas le temps ou la compétence pour s’informer sur le sujet.
Les post sur ce blog auront donc deux buts :
• apporter des informations à jour sur la douleur et la thérapie manuelle,
• susciter l’analyse critique de notre pratique au vu des meilleurs niveaux de preuves disponibles









